[첨단 헬로티]

심전도(electrocardiograms, ECG)를 이용하는 심박 변이도(heart rate variability, HRV) 분석 기술은 심장의 자율 신경 기능 진단용으로 널리 알려진 기법이다. 이보다 전통적인 심장 기능 평가 방법은 광혈류 측정기(photoplethysmography, PPG) 파형을 사용하는 것이다.
이 방법에는 맥박 변이도(pulse rate variability, PRV)가 HRV를 대신한다. 하지만 PPG 신호 검출용으로 활용할 만한 제대로 된 알고리즘이 없어서 의료 업계에서는 PRV를 활용하여 임상 진단을 제공할 수 없었을 뿐 아니라 수면 단계, 스트레스 상태, 피로도 같은 건강 관련 생체 정보를 측정할 수도 없었다.
이 글에서는 PPG 신호를 사용하는 박동 간격 분석 기법을 위한 견고한 최고점(peak) 및 시작점(onset) 검출 알고리즘을 소개한다. 또한, 아나로그디바이스(Analog Devices, ADI)의 다중센서 워치 플랫폼을 사용하여 수집한 대규모 데이터를 통해, 이 새로운 접근법이 ECG 신호를 사용하는 박동 간격 검출 결과보다 높은 커버리지와 감도, 더 낮은 RMSSD(root mean square of successive difference)를 나타내는 것을 확인할 것이다.
심박(HR) 모니터링은 많은 웨어러블 및 임상 장비에서 중요한 기능이다. 하지만 박동 간격을 사용해서 연속적인 심박 변이도(HRV)를 측정하는 기능은 아직 이러한 기기에 제공되지 않는다. HRV는 심전도(ECG)에서 얻어지는 심장박동 각 비트간 간격이 시간에 따라 변화하는 것을 나타내는 정보이다[1]. HRV는 자율 신경계의 교감 및 부교감 활동을 나타내는 생체 정보들을 포함하고[2] HRV는 임상적 진단과 수면 단계, 스트레스 상태, 피로도 같이 건강과 관련한 생체 정보를 측정하기 위한 용도로 널리 사용된다[2][3]. ECG 측정에는 기술적인 것들이 필요하기 때문에, 사고나 재난 발생 현장이나 전투 현장, 또는 전기적 간섭이 일어날 수 있는 장소 등에서는 ECG 사용이 어려울 수 있다[4].
HRV의 대안으로서, 광혈류 측정기(PPG)로부터 추출한 맥박 변이도(PRV)를 사용할 수 있다[5][6][7]. PPG 신호는 사람의 피부에 LED 빛을 비추고, 반사된 빛을 가지고 포토다이오드를 사용하여 혈류로 인한 반사된 신호의 세기 변화를 측정함으로써 얻는다.
또한 PPG는 심박, 동맥 혈압, 경직도, 맥박 전이 시간, 맥박 파동 속도, 심장 출력, 동맥 순응성, 주변 저항 같이 심혈관계와 관련한 정보를 제공할 수 있다[8][9][10]. 그런데 빈약한 혈액 관류, 주변 빛, 특히 무엇보다 움직임에 의한 신호왜곡(motion artifact, MA)으로 인해서 PPG 기반 알고리즘의 성능이 저하될 수 있다[11]. 이러한 문제를 해결하기 위해서 ADI의 모션 제거 및 주파수 추적 알고리즘 같은 많은 신호 처리 기법들이 제안되고 있다. PPG 센서 가까이에 3축 가속도계 센서를 사용함으로써 MA 잡음을 제거할 수 있다.
PRV 분석을 위해서는 PPG 파형으로부터 수축기 최고점, 시작점, 중복맥 같은 중요한 지점들을 추출해야 한다[12]. PPG 파형에서 시작점은 혈액이 심장에서 대동맥으로 뿜어져 나올 때이고, 중복맥은 혈액이 뿜어져 나오는 것이 끝나고 대동맥 판막이 닫히는 때이다. 지금까지는 적어도 부분적으로는 PPG 용으로 제대로 된 검출 알고리즘을 이용할 수 없어서 연구자들이 본격적으로 PPG를 사용해서 PRV 분석을 할 수 없었다. PRV에 관한 이전의 연구는 어떤 것은 기준점을 무시하고 있고[13], 또 어떤 것은 수축기 최고점을 수작업으로 검출하고[14], 또 어떤 것은 검증되지 않은 시간 윈도우 기반 알고리즘을 사용해서 맥박 최고점을 구하고 있다[15].
이 글에서는 동맥 혈압(arterial blood pressure, ABP) 파형 용으로 제안된 딜리니에이션(delineation) 기법을 사용하는 견고한 최고점 및 시작점 검출 알고리즘을 소개한다[16]. 손목 착용 웨어러블 기기를 통해 획득한 PPG 신호는 MA, 베이스라인 변동, 반사파, 그 밖에 검출 알고리즘 동작에 영향을 미칠 수 있는 기타 잡음을 포함할 수 있다[6]. 그러므로 먼저 데이터를 전처리를 하고 나서 박동 간격 추출 모델로 전달해야 한다.
이 연구에 사용된 자동 딜리니에이션은 하이브리드 기법으로서, 원시 PPG로부터의 서로 다른 전처리 신호와 이들 신호의 일차 도함수를 사용해서 최고점과 시작점을 추출한다. 이 연구에서는 ADI 워치 플랫폼을 사용해서 PPG 신호와 ECG 신호를 동시에 포착한 대규모 데이터베이스를 사용했다. 이 알고리즘은 메모리 풋프린트 면에서 경량이며 ADI 워치 플랫폼에 임베디드 알고리즘으로 사용할 수 있다. 이 알고리즘은 이미 검증되었으며, 커버리지, 감도, 양성 예측도, RMSSD 같은 지표를 사용하는 ECG 신호로부터 얻은 박동 간격 결과와 비교 검증되었다[17].

▲ 그림 1: 박동 간격 추출 알고리즘 흐름도. (i) 전처리 단계와 (ii)고분해능 박동 간격 추출 단계로 이루어진다.
PPG 형태에 기반한 박동 간격 알고리즘
손목 착용형 PPG 신호 용으로 (i) 전처리 단계와 (ii) 고분해능 박동 간격 추출 단계로 이루어진 이 박동 간격 알고리즘에 대해서 좀더 자세히 알아보자. 그림 1은 이 알고리즘의 블록 다이어그램을 나타낸다.
(i) 전처리
PPG 신호가 주변 조직으로 인한 빈약한 혈액 관류와 MA에 취약하다는 것은 이미 널리 알려져 있다[18]. PPG 분석의 후속 단계로 이러한 요인들의 영향을 최소화하기 위해서 전처리 단계가 필요하다. 이 단계는 다음으로 이루어진다:
▶ 프레이밍과 윈도잉
▶ 대역통과 필터링(0.4 ~ 4Hz)
▶ 신호 레벨을 제한하기 위한 자동 이득 제어(AGC)
▶ 신호 스무딩과 베이스라인 완더링 제거
T0 초 윈도우를 사용해서 PPG 입력 데이터를 처리하고 mT0(예를 들어 m = 3/4)이 겹쳐지도록 윈도우를 옮겨서 후속 블록들을 처리한다. 그 다음에는 대역통과 필터를 사용해서 PPG 신호의 고주파수 성분(전원 등)과 모세혈관 밀도, 정맥 혈류량, 체온 변화 같은 저주파수 성분을 제거한다. 그림 2a와 그림 2b는 필터링을 하기 전과 후의 PPG 신호를 보여준다. 이 필터는 컷오프 주파수가 0.4 ~ 4Hz까지다.
HR의 기본 주파수는 0.4 ~ 3Hz까지이므로, 이보다 좀더 높은 범위를 사용한다. 필터링된 신호로부터 메디안 필터를 사용해서 순간적인 스파이크를 제거한다. 다음에는 AGC 모듈이 신호 레벨을 ±V 볼트로 제한하고 후속 단계에서 신호의 크기를 검사해서 선택한 최고점을 검사한다. HRV 측정을 위한 계속적인 PPG 측정은 불가피하게 베이스라인 완더링 같은 또 다른 형태의 아티팩트를 일으킨다. 따라서 저역통과 FIR(finite impulse response) 필터를 사용하여 프레임에서 PPG 샘플 어레이를 매끄럽게 해서(그림 2c) 베이스라인 완더링 잡음을 제거하고 딜리니에이션 모듈을 위해 좀더 매끄러워진 신호를 얻을 수 있다.
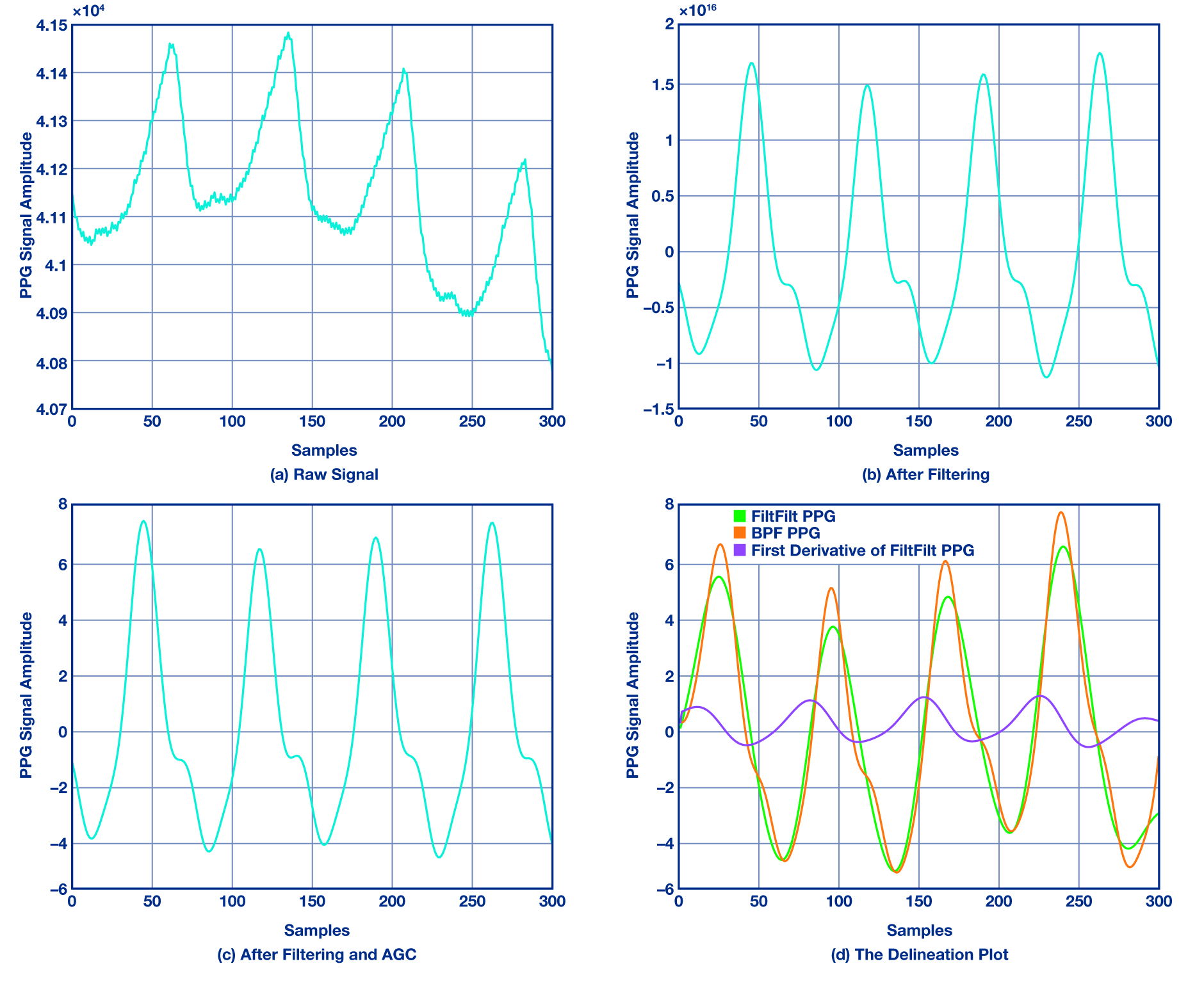
▲ 그림 2: PPG 플롯
(ii) 고분해능 박동 간격 추출 모듈
이 박동 간격 추출 알고리즘은 다음과 같이 이루어진다.
▶ 보간
▶ 딜리니에이션
▶ 고분해능 박동 간격 추출
▶ 신호 품질 지표
박동 간격 추출 알고리즘의 정확도를 높이기 위해서 전처리 모듈의 출력을 보간(interpolation) 블록으로 보낸다. t0부터 tT까지의 PPG 세그먼트가 b0부터 bT까지의 박동 간격으로 첫 번째 프레임에 주어지면, 끝점들 사이에 n개의 지점을 사용해서 박동 간격 값을 선형적으로 보간한 다음, b0부터 bT까지 고분해능 박동 간격을 추출할 수 있다(예를 들면 1ms 분해능). 그런 다음 딜리니에이션 모듈이 신호 형태와 주기 정보를 사용해서 최고점과 시작점을 추출한다. 그러므로 박동 간격 검출을 위해서는 수축기 최고점뿐 아니라 시작점과 중복맥 또한 필요하다.
여기서 제안하고 있는 딜리니에이터는 “광혈류 측정기 파형 용의 적응식 딜리니에이터(An Adaptive Delineator for Photoplethysmography Waveforms)”[12]와 “동맥 혈압 파형 용의 자동 딜리니에이터(On an Automatic Delineator for Arterial Blood Pressure Waveforms)”[16] 논문과 이론상 같은 것으로서, 신호의 일차 도함수로부터 변곡점 및 제로 크로싱 점 쌍을 사용해서 손목형 PPG 신호에 맞게 변형했다. 그림 2d에서는 PPG 분석과 관련한 변곡점과 제로 크로싱 점들을 볼 수 있다.
제로 크로싱 점들에 대해서 제로 위상 왜곡 필터를 사용해서 신호를 처리해서 애초 상태와 일치시킴으로써 시작과 끝의 과도 응답을 최소화한다. 이것은 필터링 후에도 시간 도메인 특성이 유지되도록 하기 위한 것이다. PPG 파형의 도함수로부터 시작점은 최대 변곡점 전의 제로 크로싱 점에 해당되며, 수축기 최고점은 변곡점 후의 제로 크로싱에 해당된다. 이 박동 간격 알고리즘에 사용된 신호 품질 지표는 선명도로서, 이것은 신호가 톤을 포함하는 정도를 나타낸다.
이 지표는 원래 필립 맥클리오드(Philip McLeod)와 지오프 와이빌(Geoff Wyvill)의 논문인 “피치를 찾기 위한 스마트한 방법(A Smarter Way to Find Pitch)”[19]에서 제안된 것이다. 이 논문에서는 신호의 주기성을 찾아내기 위해서 정규화 제곱 차이 함수(일종의 자동상관화 함수)를 사용한다.
[참고문헌]
1 H. Posada-Quintero, D. Delisle-Rodríguez, M. Cuadra-Sanz, and R. F. de la Vara-Prieto. “Evaluation of Pulse Rate Variability Obtained by the Pulse Onsets of the Photoplethysmographic Signal.” Physiological Measurement, Vol. 34, No. 2, p. 179, February 2013.
2 Hyun Jae Baek and JaeWook Shin. “Effect of Missing Interbeat Interval Data on Heart Rate Variability Analysis Using Wrist Worn Wearables.” Journal of Medical Systems, Vol. 41, No. 10, p. 147, 2017.
3 Tine Willum Hansen, Jan A. Staessen, Christian Torp-Pedersen, Susanne Rasmussen, Lutgarde Thijs, Hans Ibsen, and Jørgen Jeppesen. “Prognostic Value of Aortic Pulse Wave Velocity as Index of Arterial Stiffness in the General Population.” Circulation, Vol. 113, No. 5, p. 664–670, 2006.
4 Chun-Chieh Hsiao, Fang-Wei Hsu, Ren-Guey Lee, and Robert Lin. “Correlation Analysis of Heart Rate Variability Between PPG and ECG for Wearable Devices in Different Postures.” 2017 IEEE International Conference on Systems, Man, and Cybernetics (SMC).
5 Eduardo Gil, Michele Orini, Raquel Bailon, José María Vergara, Luca Mainardi, and Pablo Laguna. “Photoplethysmography Pulse Rate Variability as a Surrogate Measurement of Heart Rate Variability During Nonstationary Conditions.” Physiological Measurement, Vol. 31, No. 9, p. 1271, 2010.
6 Chiung Cheng Chuang, Jing Jhao Ye, Wan Chu Lin, Kuan Ting Lee, and Yu Ting Tai. “Photoplethysmography Variability as an Alternative Approach to Obtain Heart Rate Variability Information in Chronic Pain Patient.” Journal of Clinical Monitoring and Computing, Vol. 29, No. 6, pp. 801–806, 2015.
7 Sheng Lu, He Zhao, Kihwan Ju, Kunson Shin, Myoungho Lee, Kirk Harry Shelley, and Ki H. Chon. “Can Photoplethysmography Variability Serve as an Alternative Approach to Obtain Heart Rate Variability Information?” Journal of Clinical Monitoring and Computing, Vol. 22, No. 1, p. 23–29, 2008.
8 Justine I. Davies and Allan D. Struthers. “Beyond Blood Pressure: Pulse Wave Analysis–a Better Way of Assessing Cardiovascular Risk?” Future Medicine, 2005.
9 Arthur de Sa Ferreira, José Barbosa Filho, Ivan Cordovil, and Marcio Nogueira de Souza. “Three-Section Transmission-Line Arterial Model for Noninvasive Assessment of Vascular Remodeling in Primary Hypertension.” Biomedical Signal Processing and Control, Vol. 4, No. 1, p. 2–6, January 2009.
10 John Allen. “Photoplethysmography and Its Application in Clinical Physiological Measurement.” Physiological Measurement, Vol. 28, No. 3, p. R1, 2007.
11 Byung S. Kim and Sun Kyung Yoo. “Motion Artifact Reduction In Photoplethysmography Using Independent Component Analysis.” IEEE Transactions on Biomedical Engineering, Vol. 53, No. 3, p. 566–568, April 2006.
12 Mohanalakshmi Soundararajan, Sivasubramanian Arunagiri, and Swarnalatha Alagala. “An Adaptive Delineator for Photoplethysmography Waveforms.” Biomedical Engineering/Biomedizinische Technik, Vol. 61, No. 6, p. 645– 655, January 2016.
13 Bistra Nenova and Ivo Iliev. “An Automated Algorithm for Fast Pulse Wave Detection.” International Journal Bioantomation, Vol. 14, No. 3, p. 203–216, July 2010.
14 Nandakumar Selvaraj, Ashok Kumar Jaryal, Jayashree Santhosh, Kishore K. Deepak, and Sneh Anand. “Assessment of Heart Rate Variability Derived from Fingertip Photoplethysmography as Compared to Electrocardiography.” Journal of Medical Engineering and Technology, Vol. 32, No. 6, pp. 479–484, 2008.
15 Keyne Charlot, Jérémy Cornolo, Julien V. Brugniaux, Jean-Paul Richalet, and Aurélien Pichon. “Interchangeability Between Heart Rate and Photoplethysmography Variabilities During Sympathetic Stimulations.” Physiological Measurement, Vol. 30, No. 12, p. 1357, 2009.
16 Bing Nan Li, Ming Chui Dong, and Mang I. Vai. “On an Automatic Delineator for Arterial Blood Pressure Waveforms.” Biomedical Signal Processing and Control, Vol. 5, No. 1, pp. 76–81, 2010.
17 Gary Berntson, David L. Lozano, and Yun-Ju Chen. “Filter Properties of Root Mean Square Successive Difference (RMSSD) for Heart Rate.” Psychophysiology, Vol. 42, No. 2, p. 246–252, March 2005.
18 Margareta Sandberg, Qiuxia Zhang, Jorma Styf, Björn Gerdle, and Lars-Göran Lindberg. “Noninvasive Monitoring of Muscle Blood Perfusion by Photoplethysmography: Evaluation of a New Application.” Acta Physiologica, Vol. 183, No. 4, pp. 335–343, 2005.
19 Philip McLeod and Geoff Wyvill. “A Smarter Way to Find Pitch.” ICMC, 2005.
글 / 포루하르 포루잔(Foroohar Foroozan) 아나로그디바이스 의료 사업부 생체 신호 및 가정용 모니터링 시스템 관련 토론토 알고리즘팀 리더, 지안 슈 우(Jian Shu (James) Wu) 아나로그디바이스(Analog Devices, Inc.) 인턴, 마드한 모한(Madhan Mohan) 자스민 인포테크(Jasmin Infotech)